
Dopo aver trattato (in questo nostro precedente articolo) della visione atomistica di Democrito risalente ad oltre il 400a.C. e dimenticata per quasi 2 secoli, riprendiamo questa ipotesi, ormai generalmente accettata dalla Comunità Scientifica, per spiegare alcuni semplici fenomeni che si presentano sotto i nostri occhi tutti i giorni.
La Materia è fatta di atomi, piccole particelle in perpetuo movimento, che si attraggono a breve distanza, ma si respingono se pressate l’una contro l’altra oltre un certo limite.
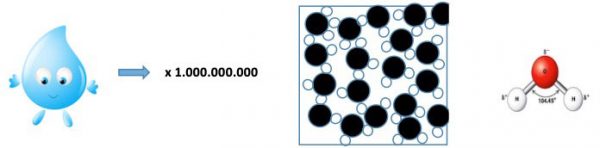
In questa frase c’è una enorme quantità di informazione su come è fatto il mondo, basta usare un po’ di fantasia e il ragionamento. Per illustrare la potenza dell’idea supponiamo di poter ingrandire una goccia d’acqua 1 miliardo di volte. Essa diventerebbe grande come l’oceano Atlantico, più o meno. Guardando la superficie dell’acqua vedremmo un cosa fatta così (Fig.1), idealizzata in molti aspetti:
- Ogni gruppo di una palla nera (ossigeno) e di due palline bianche (idrogeno) è una molecola d’acqua. Gli atomi di idrogeno sono disposti a formare un angolo di circa 104 °, e questo conferisce all’acqua alcune peculiarità (vedi oltre).
- La figura è statica mentre le molecole in realtà si muovono continuamente. Si chiama agitazione termica perché è ciò che noi rappresentiamo come calore: quando aumenta la temperatura, aumenta il movimento.
- Le particelle sono «incollate» insieme ma se si comprimono si respingono (l’acqua è incompressibile)
- L’attrazione tra molecole spiega perché un goccia d’acqua su un piano inclinato scorre senza disgregarsi.
Mettiamo poca acqua in un recipiente cilindrico a temperatura ambiente T (Fig. 2). Le molecole si agitano a velocità diverse. Alcune (le più veloci) riescono a staccarsi dalle altre, e volano via: è l’evaporazione (la biancheria si asciuga così). Se riscaldo, cioè fornisco calore, cioè agitazione molecolare, aumenta la temperatura e quindi l’evaporazione. Abbiamo vapore nelle vicinanze della superficie dell’acqua mentre in profondità c’è solo acqua.
Mettiamo ora un pistone nel cilindro (Fig.3) e continuiamo a fornire calore aumentando così la temperatura. A 100°C inizia l’ebollizione dell’acqua, dovuta al fatto che cominciano a separarsi le molecole in profondità, creando delle bolle di vapore che vengono in superficie.
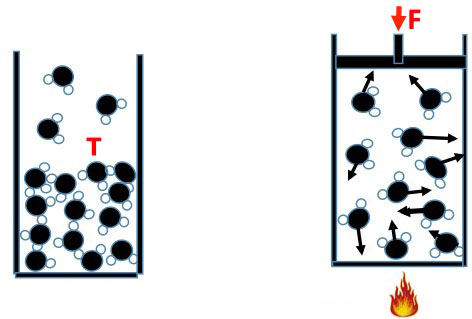
Durante l’ebollizione la temperatura resta a 100°C perché tutto il calore fornito è speso per separare le molecole. Le molecole di vapore ora si agitano molto velocemente e urteranno le pareti del recipiente più violentemente. Gli urti sul pistone tenderanno a farlo salire, per cui per tenerlo fermo dovremo applicare una certa forza di contrasto F, uguale e contraria a quella interna che spinge il pistone in su. La forza divisa per l’area del pistone si chiama pressione e si misura in Kg/cmq.
Osserviamo un’altra cosa: se aumentiamo la temperatura, le molecole aumentano la loro agitazione, gli urti sulle pareti diventano più forti e più frequenti e quindi aumenta la pressione; e osserviamone un’altra: se abbassiamo il pistone verso il basso le molecole lo colpiscono e rimbalzano con velocità più alta (pensiamo ad palla da tennis colpita dalla racchetta), dunque diventano più calde, dunque quando comprimiamo il vapore ma anche un qualsiasi gas, la sua temperatura aumenta.
Abbiamo quindi imparato che quando comprimiamo un gas questo si riscalda e, al contrario, quando un gas si espande esso si raffredda.
In un frigorifero (o in un condizionatore d’aria) un gas viene fatto espandere nella serpentina interna, che si raffredda sottraendo calore ai cibi (o alla stanza) e viene compresso nella serpentina esterna riscaldandosi e cedendo il calore all’esterno. E’ esperienza comune e vediamo quanto sono semplici le idee della teoria atomica!
Ora vediamo cosa succede quando raffreddiamo l’acqua (mettiamola pure in un congelatore per fare presto!). Le molecole si muovono sempre più lentamente fino a restare incastrate come in Fig. 4 quando la temperatura scende fino a 0°C : è il Ghiaccio.
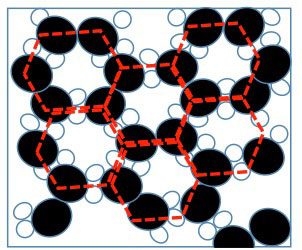
Si tratta di una struttura cristallina che si ripete nello spazio con simmetria esagonale. Questo significa che se fissiamo gli atomi in una certa posizione della goccia, alla estremità opposta della goccia la posizione degli atomi è automaticamente fissata, cioè un ghiacciolo non si disgrega come l’acqua, è solido.
Tutti i solidi sono caratterizzati da strutture cristalline come questa e atomi a grande distanza l’uno dall’altro non occupano posizioni casuali, ma posizioni determinate dalla posizione di atomi a miliardi di atomi di distanza.
Dalla figura si capisce anche perché il l’acqua aumenta di volume quando solidifica in ghiaccio: la struttura cristallina è piena di buchi!! questa è una caratteristica solo dell’acqua perché quasi tutti i liquidi quando solidificano diminuiscono di volume perchè al diminuire della temperatura, cioè della velocità di vibrazione degli atomi, questi tendono a incollarsi in strutture cristalline molto compatte (Fig.5)

La struttura cristallina piena di buchi del ghiaccio spiega anche perché è più leggero dell’acqua liquida e quindi galleggia in essa, come i grandi iceberg (Fig.6)

Mettiamo ora dell’acqua in un bicchiere e copriamolo. Aiutiamoci con la Fig. 7.
Ci saranno molecole più veloci (più calde) e molecole meno veloci (meno calde). Ci sarà una velocità media e quindi una temperatura media T. Succede che alcune molecole più veloci si staccano dalla superficie e vanno nella zona aria. Altre molecole che sono già in zona (diciamo che c’è del vapore) si avvicinano alla superficie d’acqua e ne vengono catturate: in breve c’è un equilibrio tra le molecole che si staccano e quelle catturate, globalmente non cambia nulla e la temperatura resta T.
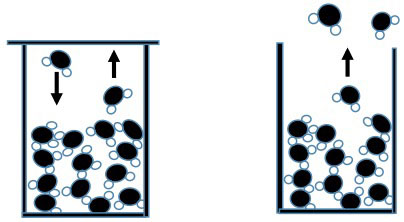
Se però tolgo il coperchio, alcune delle molecole volano via e non tornano più. Se ne vanno le più veloci, cioè le più calde. Tendono a restare quelle meno veloci, cioè quelle meno calde: dunque l’acqua si raffredda.
E’ il meccanismo della Termoregolazione del corpo umano: La sudorazione serve a mantenere costante la temperatura del corpo: se la nostra temperatura sale, l’acqua evapora attraverso la pelle, sottraendo calore al corpo. Quando fa molto caldo però, la temperatura del vapore vicino alla pelle è alta: si crea la situazione dell’acqua nel bicchiere coperto, cioè uno strato di vapore in equilibrio sulla pelle: tante molecole di vapore escono dalla pelle quante ne rientrano. Si blocca la sudorazione e quindi aumenta la temperatura del corpo con conseguente sensazione di malessere. Con un ventilatore le cose vanno meglio perché vengono rimosse dallo strato le molecole di vapore, quelle più veloci (calde), riattivando così la sudorazione (Fig.8). Per la stessa ragione soffiamo sulla minestra bollente!

Ed infine vediamo perché e come il sale, come tante altre sostanze, si sciolgono nell’acqua.
In un recipiente contenente sale da cucina (NaCl = Cloruro di Sodio) versiamo dell’acqua.
Il sale è costituito da coppie di ioni Na+ e Cl- attaccati tra loro per via dell’attrazione elettrica. La molecola di acqua è fatta da un atomo di O- con due H+ (Fig. 9)
Succede che gli H+ tenderanno ad attrarre i Cl- staccandoli dal compagno Na+, il quale a sua volta è tirato da O-. In figura sono rappresentati due atomi di Cl (rossi) e uno di Na (blu) catturati da molecole d’acqua, cioè molecole di sale spacchettate nei componenti Na e Cl: il sale si è sciolto!
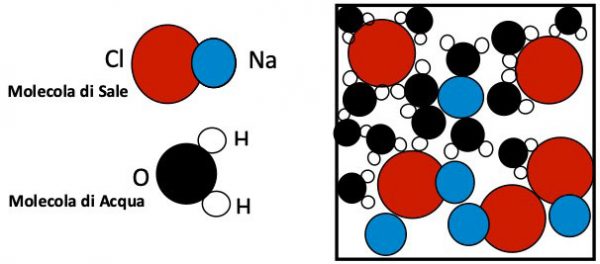
Sappiamo che a 0°C le molecole d’acqua si raggruppano in una struttura cristallina esagonale che è il ghiaccio (vedi). Ora la presenza di grossi ioni di Na e Cl ostacola questo processo abbassando la temperatura di solidificazione a -6°C. Ecco perché sulle strade si sparge sale quando la temperatura scende intorno a 0°C.
Tutte le cose sono fatte di atomi: questa è l’ipotesi chiave.
Il mondo è fatto di atomi interagenti secondo le leggi della fisica. Questo fatto non è noto da sempre: ci vollero tanti esperimenti e teorizzazioni per arrivare a questa ipotesi, ma ora è universalmente accettata, ed è la teoria più utile per dar vita a nuove idee sulla comprensione del mondo in cui viviamo.
Anche noi siamo un ammasso di atomi, ma non solo un ammasso di atomi: perché un ammasso di atomi che non siano disposti in una configurazione identicamente ripetuta, come nei cristalli e nel ghiaccio, ha quel quid di possibilità uniche che vediamo davanti a noi guardandoci nello specchio!
Bibliografia:
Richard Feynman – sei pezzi facili. ADELPHI editore
Luigi Catalani nasce a Norma (LT) nel 1946. Si laurea in Ingegneria Elettronica con indirizzo Calcolatori e Controlli Automatici nel 1975. E’ assunto da una società romana leader nel settore della Meccanottica di precisione occupandosi di progettazione elettronica e software di sistemi di Aereofotogrammetria per applicazioni cartografiche civili e militari. Nel 1980 è assunto da una primaria azienda Aerospaziale italiana come dirigente del reparto progettazione e sviluppo di apparati avionici di bordo per aerei ed elicotteri militari e civili. Nel 1988 passa alle dipendenze di una società romana leader nel settore dei sistemi di difesa avionica con l’incarico di Project Manager per diversi contratti internazionali per lo sviluppo e produzione di apparati destinati alle aeronautiche di Italia, Germania, UK e Spagna. Nel 2007,nella stessa società, conclude la sua carriera in qualità di Responsabile Commerciale degli stessi contratti.


