
Una collega di Lucrezia, non amando la bistecca, si è fatta portare un filetto di sogliola con contorno di uova sode.
La cottura dell’uovo è un altro bell’esempio di reazione chimica.
Un uovo di gallina contiene il 74% di acqua, il 12% di proteine e l’11% di grassi. Vi sono poi piccole quantità di vitamine, sali minerali e altre sostanze. I grassi sono concentrati nel tuorlo, l’albume è prevalentemente costituito da una soluzione di proteine in acqua.
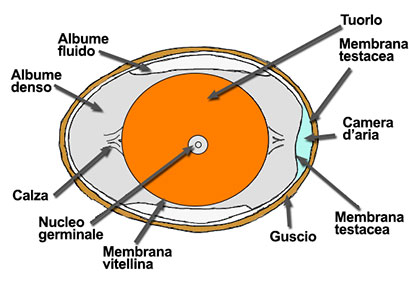
Quando, nella cottura, viene aumentata la temperatura, inizia un processo chiamato DENATURAZIONE nel corso del quale le lunghe catene proteiche (formate da un gran numero di amminoacidi) si srotolano originando progressivamente un reticolo tridimensionale che può intrappolare molecole d’acqua al suo interno.

Se il processo di denaturazione è troppo spinto (cottura eccessiva) l’albume diventa gommoso e il tuorlo rinsecchito risultando poco gradevoli al palato. Nell’albume vi è circa il 12% di una proteina chiamata OVOTRANSFERRINA che solidifica tra i 62° e i 65°C.
Una seconda proteina dell’albume, l’OVALBUMINA, che ne costituisce il 54% coagula invece a 85°C e quindi, a questa temperatura, l’albume diventa molto più compatto. Le poche proteine del tuorlo solidificano a 70°C.
Da quanto detto non è così semplice cuocere un uovo a regola d’arte affinchè diventi sodo (bisogna controllare molto bene la temperatura). Lucrezia nota però, nel piatto dell’amica, una poco attraente colorazione grigio-verdognola attorno al tuorlo.

Questo accade perché l’albume (in particolare a causa dell’amminoacido CISTEINA) sviluppa ACIDO SOLFIDRICO, una sostanza gassosa dal tipico odore di uova marce.
L’ACIDO SOLFIDRICO può reagire con il FERRO presente nel tuorlo e formare SOLFURO FERROSO di colore scuro che, mischiato con il giallo del tuorlo, origina la colorazione verdognola.
Per evitare ciò si suggerisce, dopo aver estratto l’uovo dall’acqua calda al termine del tempo di cottura stabilito, di porlo sotto acqua corrente fredda per evitare che la cottura prosegua.
Terminato l’uovo sodo, la collega di Lucrezia, si accinge a gustare il filetto di sogliola e, quasi come una sorta di riflesso condizionato, prende lo spicchio di limone e lo spreme sul pesce.

L’odore che il pesce emana (anche quando è freschissimo) è dovuto ad un composto chimico chiamato TRIMETILAMMINA, molecola piuttosto volatile per cui la liberazione di piccole quantità di essa da parte del pesce viene facilmente avvertita dal nostro naso.
La TRIMETILAMMINA è un composto basico che può quindi reagire con un composto acido. Il succo di limone contiene ACIDO CITRICO.

Quando spruzziamo il limone sul pesce, la TRIMETILAMMINA reagisce con l’acido citrico trasformandosi in un in una molecola non volatile ed eliminando quindi lo sgradevole odore.
In varie ricette, il pesce viene spesso abbinato a sostanze acide (per es. la semplice passata di pomodoro). La tradizione culinaria ha intuito, senza sapere perché, una verità che la chimica ha ben compreso.
Il succo di limone può addirittura denaturare le proteine della carne del pesce determinandone lo sbiancamento.

E’ il caso delle acciughe marinate, ottimo piatto che, per essere gustato in sicurezza è necessario, prima della marinatura, sottoporre le acciughe stesse ad un lungo abbattimento a temperature molto basse.
Il vicino di tavola di Lucrezia è il potente direttore delle risorse umane e si sta gustando un piatto di broccoletti ripassati con parecchio aglio e ahimè il suo alito ne risente in maniera vistosa.

Il composto chimico responsabile di quel fastidioso odore è il DIPROPENILDISOLFURO (abbreviato in DPDS) contenuto nell’aglio.
Il DPDS durante la sua assunzione viene trasformato nel nostro organismo in METILMERCAPTANO molecola molto volatile e dall’odore pungente che viene eliminata con il respiro.
Il DPDS viene commercializzato come “essenza di aglio” ed è uno dei farmaci da banco più venduti in Germania. Una delle indicazioni di questo farmaco, oltre alla sua capacità di ridurre il livello di colesterolo e a quella di agire a livello pressorio, è quella di avere la capacità di prevenire le malattie infettive: forse perché tiene lontano le persone che ti stanno intorno???

Il METILMERCAPTANO è inoltre responsabile della ALITOSI in quanto i batteri orofaringei decompongono gli amminoacidi CISTEINA e METIONINA (contenenti ZOLFO), che assumiamo con l’alimentazione, producendo METILMERCAPTANO.
Questa sostanza volatile è altresì responsabile del cattivo odore dei piedi in quanto in piedi non lavati, calze sporche e umide e scarpe non aerate prosperano batteri quali gli staffilococchi e i corine batteri che producono, in determinate condizioni, METILMERCAPTANO.

Il METILMERCAPTANO è però anche molto utile in quanto viene immesso, in piccolissime quantità, nella rete del gas METANO per poter rilevare (dall’odore) anche piccolissime perdite (il METANO da solo è totalmente inodore).
E’ inoltre usato nella sintesi chimica dell’amminoacido essenziale METIONINA utilizzato poi, in integratori alimentari, da individui carenti di questo amminoacido. Il lauto pranzo si è concluso e la comitiva lascia il ristorante per avviarsi in azienda per un intenso pomeriggio di lavoro.
LA CHIMICA IN VERSI
di Alberto Cavaliere
ZOLFO
Corpo notissimo fin dal passato
più immemorabile, fu annoverato
fra i corpi semplici quest’elemento
solo nel volgere del settecento.
E’ abbondantissimo: nel Bel Paese,
anzi, n’esistono miniere estese.
Nella Germania e in altri siti
esso ricavasi dalle piriti.
Nella Sicilia, dove allo stato
libero trovasi cristallizzato,
s’ottien col metodo del calcarone
(in modo analogo che pel carbone)
in cui s’adopera lungo il processo
per combustibile lo zolfo stesso.
dei vecchi metodi forse è il men peggio.
Così ricavasi lo zolfo greggio.
Se poi, bruciandolo, entro le mura
d’una gran camera di muratura
si fanno giungere i suoi vapori,
vi si deposita lo zolfo in fiori,
il quale in seguito si liquefà
e in forme coniche di legno va,
formando il solido zolfo in cannelli,
ossia in lunghissimi aghi, assai belli.
Sostanza insipida, giallo-citrina,
molto solubile nella benzina,
a cento e undici gradi esso fonde
formando un liquido giallo; d’altronde,
se ancor riscaldasi, diventa denso,
vischioso, tingesi d’un bruno intenso,
sì che ai centigradi duecentoventi,
capovolgendone i recipienti
che lo contengono, non lo si versa;
ed innalzandolo poi, viceversa,
a ancor più energica temperatura
ridivien fluido, ma più s’oscura,
finché, sul volgere dei quattrocento,
il nostro siculo strano elemento
dei densi nugoli ranciati estolle;
le metamorfosi cessano: ei bolle.
Numerosissime le applicazioni:
serve a molteplici fabbricazioni.
Ci dà i fiammiferi: s’intende,
quelli che il nome traggono di zolfanelli.
La scienza medica lo sfrutta pure,
utilizzandolo per molte cure:
chi non l’adopera, chi non l’agogna,
quando implacabile prude la rogna?

Fausto Bonifacio nasce a Milano nel 1951, si laurea in Chimica Pura nel 1975 e dopo un anno di servizio militare viene assunto, presso un’importante azienda farmaceutica milanese, con la mansione di operatore di laboratorio di ricerca.
Nel 1988 emigra, al contrario, nella città di Frosinone e prende servizio quale direttore della funzione Ricerca e Sviluppo di una nota azienda chimico-farmaceutica operante nel settore della sintesi e produzione di principi attivi .
Nel 1998 viene assunto, con la qualifica di direttore Ricerca e Sviluppo, da una nota azienda chimico-farmaceutica situata nei pressi di Latina e ricopre inoltre lo stesso incarico nella consociata spagnola di tale azienda.
Nel 2004 emigra in toscana presso un’importante azienda chimico-farmaceutica dove ricopre la carica di direttore di stabilimento fino al 2013 quando cessa l’attività lavorativa godendosi poi la meritata pensione.
Attualmente vive e saltuariamente lavora a Latina.


