
Lucrezia ha quasi concluso la lettura della sua relazione ma gli è venuta sete, si alza dalla scrivania e si avvia a prendere un bicchiere di acqua fresca dal boccione che si trova nel corridoio del suo ufficio.
Bere un bicchiere di acqua è considerato, per antonomasia, la cosa più semplice del mondo.
L’acqua è fondamentale per la nostra sopravvivenza e lo studio delle sue caratteristiche è tutt’altro che banale.
In Italia consumiamo circa un miliardo di litri al mese di acqua minerale in bottiglia. Siamo i maggiori consumatori di acqua al mondo seguiti a ruota dai tedeschi.
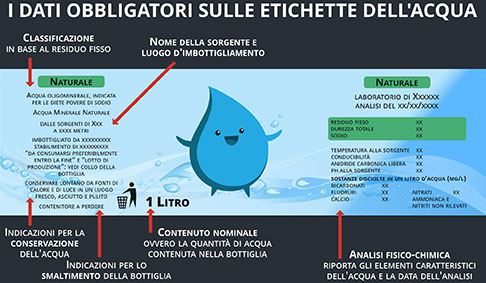
Vediamo di analizzare l’etichetta di una bottiglia che abbiamo in casa, sono obbligatorie per legge queste informazioni:
- acqua minerale naturale (non acqua di sorgente o acqua da bere)
- nome della sorgente
- composizione chimica
- contenuto nominale
- titolare autorizzazione al commercio
- il N° di lotto e la scadenza
Nell’analisi chimica ci soffermeremo sulle seguenti caratteristiche: contenuto in SODIO, RESIDUO FISSO contenuto in NITRATI, contenuto in ANIDRIDE CARBONICA libera e contenuto in CALCIO.

Nel corpo umano sono presenti circa 100 grammi di SODIO ed il nostro fabbisogno giornaliero si aggira intorno ai 3,5 grammi. Il SODIO è contenuto in quasi tutti gli alimenti che conosciamo(persino nel latte), ciò significa che, al giorno, ne assumiamo più o meno 3-4 volte di più di quello che ci necessita. Quindi il contenuto di questo elemento nell’acqua minerale è totalmente ininfluente rispetto a quanto introdotto con l’alimentazione (pensate che un litro di acqua minerale contiene da 5 a 10 milligrammi di SODIO).

Il RESIDUO FISSO è la quantità di sali minerali depositati da un litro di acqua minerale fatta evaporare a 180°C ed è espresso in milligrammi/litro. Se questo valore è inferiore a 50 milligrammi/litro abbiamo una acqua : MINIMAMENTE MINERALIZZATA: leggera, favorisce la diuresi e facilita l’espulsione di piccoli calcoli renali. Fino a 500 milligrammi/litro abbiamo un’acqua OLIGOMINERALE: ottima acqua da tavola, digestiva, svolge azione diuretica. Tra 500 e 1000 milligrammi/litro abbiamo un’acqua MINERALE: non deve essere bevuta in quantità eccessive (max. un litro/die) alternandola con acqua OLIGOMINERALE. Oltre i 1000 milligrammi/litro abbiamo un’acqua RICCA di SALI MINERALI: queste acque si usano a scopo curativo su consiglio medico e si acquistano prevalentemente in farmacia (avete presente la pubblicità dell’acqua ESSENZIALE delle Terme di Boario?).

Il contenuto in NITRATI è espresso in milligrammi/litro ed è legato al fatto che l’uso di fertilizzanti azotati in agricoltura fa si che questi ultimi possano raggiungere le falde acquifere sottoforma di NITRATI. Sono pericolosi solo se raggiungono determinate concentrazioni; normalmente devono essere, anche per legge, sotto i 50 milligrammi/litro: considerate per es. che nell’acqua LETE siamo intorno ai 5,5 milligrammi/litro.

Il contenuto in ANIDRIDE CARBONICA libera è espresso in milligrammi/litro e rappresenta la cosiddetta effervescenza o frizzantezza e può essere di origine naturale cioè alla sorgente o legata all’aggiunta di ANIDRIDE CARBONICA gas. Non vi sono studi scientifici che abbiano mai provato gli effetti negativi sulla salute umana di acqua addizionata di ANIDRIDE CARBONICA(ovviamente questo vale per soggetti sani).

Il contenuto in CALCIO è espresso in milligrammi/litro ed è uno dei metalli essenziali per la salute umana. Il CALCIO insieme al FOSFATO è il costituente delle ossa: lo scheletro umano pesa in media 9 chilogrammi, di questi 1 chilogrammo è CALCIO e 2,5 chilogrammi sono FOSFATO (il resto è acqua, collagene e altri elementi). Una delle funzioni delle ossa è quella di mantenere stabile il livello di CALCIO nel sangue.
Quando la dieta non fornisce abbastanza CALCIO e quindi entriamo in carenza viene prelevato calcio dal nostro scheletro ed in seguito, quando nel sangue sarà presente CALCIO in eccesso, sarà reintegrato nel tessuto osseo.
Da quanto sopra deriva la necessità di assumere questo metallo con la dieta. Si consideri che il fabbisogno giornaliero di CALCIO, in un individuo adulto è di circa 1000 milligrammi (cioè 1 grammo) e raggiunge i 1200 milligrammi (1,2 grammi) in età avanzata (maggiore di 60 anni), sia per i maschietti che per le femminucce.
Considerando che il CALCIO è contenuto principalmente nei formaggi e nel latte (vi sorprendereste se vi dico che è contenuto in quantità veramente importanti nelle sardine sott’olio e nella rucola?) è auspicabile utilizzare un’acqua minerale con un alto contenuto di CALCIO: per es. l’acqua LETE che ne contiene circa 300 milligrammi/litro.

La legge italiana prevede che la revisione dell’etichetta di un’acqua minerale venga fatta ogni 5 anni. Comunque le autorità sanitarie e ambientali eseguono analisi chimiche e batteriologiche almeno una volta all’anno alla sorgente e almeno una volta al mese sul prodotto finito.
Dopo essersi abbondantemente dissetata Lucrezia torna in ufficio a concludere la lettura di quella noiosa relazione.

LA CHIMICA IN VERSI
di Alberto Cavaliere
CALCIO – STRONZIO – BARIO
Corpi metallici tra loro affini,
il gruppo formano degli alcalini
terrosi, simili ai precedenti
per i lor ossidi, ma bivalenti.
Noto da un secolo come metallo,
il calcio è un solido bianco, non giallo,
mentre i due ultimi, ma specie il bario,
gialli o giallognoli son d’ordinario.
Tutti scompongono I’H2O.
Come preparansi dopo dirò.
E’ abbondantissimo, ma combinato,
il calcio, massime nel carbonato,
del quale esistono specie infinite:
la creta, il calcare, l’aragonite,
lo spato, eccetera. Lo si ritrova
in forma analoga nei gusci d’uova
mentre che un genere di suoi fosfati
forma lo scheletro dei vertebrati.
Il calcio libero s’ottiene puro
con l’elettròlisi del suo cloruro,
e a tal proposito questo va fuso;
però, metallico, non ha grand’uso.
Dall’aria umida viene alterato:
attacco chimico che forma idrato.
Scaldando il càlcare, – Ca CO3 –
via via s’elimina CO2, finchè,
verso i centigradi mille, s’arriva
a ottener l’ossido: la calce viva.
E’ questa, in genere, bianca, se è pura,
fonde ad altissima temperatura.
Arroventandola, essa produce
bianca, intensissima, stupenda, luce,
che nelle tenebre lancia un bagliore
dall’occhio vigile del riflettore.
Nell’acqua s’altera e allor diventa
idrato calcico o calce spenta:
la quale, in polvere, con acqua e sabbia
si tratta in seguito, affinché s’abbia
la malta: all’aria questa indurisce
e un corpo solido costituisce,
che non si sgretola che col piccone,
e rende stabile la costruzione
(dovrebbe renderla, ma il Novecento
non mi dà un briciolo d’affidamento,
con certe trappole di cartapesta,
che vedo sorgere così alla lesta … ).
Quando si saturi la calce spenta
con cloro libero, ci si presenta
un sale in polvere, detto cloruro
di calce, candido, che, non mai puro,
è da due solidi costituito:
cloruro calcico e ipoclorito.
S’impiega in pratica come ossidante,
più come energico decolorante:
tutte innegabili qualità buone,
però che fetida fabbricazione!
Solfato calcico: forma assai spesso
grossi prismatici cristalli: è il gesso
e due molecole d’acqua contiene.
Dall’acqua, in genere, sciolto non viene.
Se in masse trovasi molto compatte,
quasi marmoree, d’un bianco latte,
muta di termine: è l’alabrastro.
Senz’acqua, lucido, roseo o bluastro,
in grandi lamine tra loro unite,
assume il termine, poi, d’anidrite.
Se il gesso scaldasi via via, succede
che si modifica, poi ch’acqua cede
e allor origine dà a quel prodotto
noto col termine di gesso cotto;
indi, impastandolo con acqua ancora,
le due molecole riprende e allora,
tosto ch’elimina l’acqua in eccesso,
divien durissimo, formando un gesso
molto pregevole, per cui si spiega
che in opre artistiche tanto s’impiega.
In forme multiple, specie allo stato
di marmo e càlcare, il carbonato
di monti genera vaste catene.
Esso è insolubile nell’acqua: bene!
Marmo, sei nobile; marmo, sei bello,
anche se, gelido, chiudi un avello.
Blocco granitico, superba mole,
solenne e candido brilli nel sole
delle magnifiche Alpi Apuane,
donde ti traggono le braccia umane.
Tenace e docile, saldo e ubbidiente,
ti muti subito, divinamente,
in archi, cupole, templi e produci
inimitabili riflessi e luci.
Da te si libera quasi un’essenza
d’aristocratica grazia e potenza:
connubio classico che ancor s’impone
dai bianchi ruderi del Partenone.
Incorruttibile e immacolato,
dài vita a fulgidi sogni… Peccato
che ti s’adoperi per monumenti
piuttosto inutili, nonché scadenti,
alzati ai soliti Carneadi illustri,
dei quali il pubblico, dopo due lustri,
non sa decidere se siano stati
poeti o apostoli, sofi o scienziati!
In certe splendide città d’Italia,
che l’arte domina, che il sole ammalia,
fra templi e portici sublimi, vedi
certe cariatidi, sedute o in piedi,
in tuba, in tonaca o in isparato,
che ti fan gemere: ” Marmo sprecato!… “,
che ti fan chiedere: ” Marmo, perché
sei tu insolubile nell’acqua, ahimé? “
Con una provvida pioggia sai pure
che sparirebbero tante brutture!…
Importantissimo è il silicato:
con vari metodi viene impiegato
e già moltissimi secoli addietro
anche impiegavasi per fare il vetro.
Carbone ed ossido di calcio puro
nel forno elettrico danno il carburo,
utilizzabile sia per la luce,
sia perché gli ossidi molto riduce.
Dall’acqua e un acido scomposto viene,
formando subito l’acetilene,
che con bellissima fiamma, sì, brucia,
ma ispira in genere poca fiducia,
ché lo contamina un vizio tristo:
quello di esplodere se all’acqua è misto.
(Questo è un anticipo senza costrutto:
poi, nell'”Organica “, vi dirò tutto).
Infin, possiedono gli Stati Uniti
ricchi depositi di fosforiti,
da cui ricavansi i perfosfati,
concimi chimici molto impiegati
che al suolo imprimono novella possa.
Essi s’ottengono pure dall’ossa,
che, trite in polvere, poi con speciali
sistemi trattansi e gli animali
con ciclo assiduo, dunque, così.
La terra nutrono che li nutrì.
Lo stronzio e il bario formano sali,
rispetto ai calcici, poco essenziali,
e che s’impiegano su vasta scala
in pirotecnica per i ” bengala “.
Al calcio simili, s’ottengon puri
con l’elettròlisi dei lor cloruri.
Se abbonda il bario, lo stronzio (strano!),
che abbondantissimo crede il profano,
difetta e trovasi, in fondo in fondo,
tra i corpi semplici più scarsi al mondo.

Fausto Bonifacio nasce a Milano nel 1951, si laurea in Chimica Pura nel 1975 e dopo un anno di servizio militare viene assunto, presso un’importante azienda farmaceutica milanese, con la mansione di operatore di laboratorio di ricerca.
Nel 1988 emigra, al contrario, nella città di Frosinone e prende servizio quale direttore della funzione Ricerca e Sviluppo di una nota azienda chimico-farmaceutica operante nel settore della sintesi e produzione di principi attivi .
Nel 1998 viene assunto, con la qualifica di direttore Ricerca e Sviluppo, da una nota azienda chimico-farmaceutica situata nei pressi di Latina e ricopre inoltre lo stesso incarico nella consociata spagnola di tale azienda.
Nel 2004 emigra in toscana presso un’importante azienda chimico-farmaceutica dove ricopre la carica di direttore di stabilimento fino al 2013 quando cessa l’attività lavorativa godendosi poi la meritata pensione.
Attualmente vive e saltuariamente lavora a Latina.


