
E’ arrivata l’ora di chiudere con il lavoro, Lucrezia riordina la scrivania e si prepara per uscire.
Finalmente esce in strada, in cielo ci sono grandi nuvole bianche con le forme più strane: perchè hanno quel colore?
Le nuvole sono costituite da goccioline d’acqua sospese in aria.
Si tratta quindi di oggetti ben più grandi delle molecole e della lunghezza d’onda della luce. In questo caso la luce viene diffusa in tutte le direzioni, ma in egual misura indipendentemente dal valore della lunghezza d’onda e, come sappiamo, l’insieme di tutte le lunghezze d’onda provoca nei nostri occhi la sensazione del bianco.
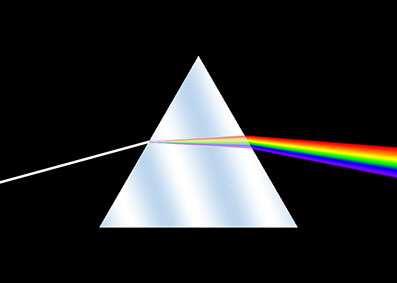
Ragionando di queste cose Lucrezia si chiede come mai all’alba e al tramonto il cielo appare rossastro.
In questo caso il fenomeno coinvolto non è più dovuto ad una diffusione, ma è costituito dall’assorbimento di radiazione da parte delle molecole dell’aria.
All’alba e al tramonto, infatti, il sole è basso rispetto all’orizzonte e la luce proveniente da esso è più radente rispetto alla superficie terrestre.
Essa quindi deve attraversare uno strato di atmosfera più spesso e di conseguenza viene maggiormente assorbita.
Le molecole dei gas presenti nell’aria assorbono però principalmente le radiazioni a lunghezze d’onda più basse, mentre quelle a lunghezze d’onda più alte (il rosso per es.) riescono a passare indenni.
Per questo motivo la luce che arriva ai nostri occhi è più ricca della componente rossa.

Lucrezia, prima di uscire dall’ufficio, ha dato uno sguardo alle previsioni meteo: sono previste nevicate e probabili gelate e il comune ha previsto lo spargimento di sale per le strade.
Infatti sul viale prospiciente l’ufficio sta passando un mezzo spargisale e Lucrezia si domanda:
“che senso ha spargere il sale sulle strade?”

L’acqua pura, alla pressione atmosferica, congela a 0°C, il che equivale a dire che il ghiaccio fonde a questa stessa temperatura. Una soluzione di acqua e sale invece congela a temperatura più bassa.
L’abbassamento della temperatura dipende dalla quantità di sale aggiunta. Se si usa il normale sale da cucina (cloruro di sodio) la temperatura più bassa raggiungibile è di -21,3°C.
Da quanto sopra ecco perché, per evitare la formazione di ghiaccio sulle strade a temperature sotto lo zero, si usa il sale.
A quell’ora c’è un traffico molto intenso e Lucrezia è infastidita sia dall’inquinamento acustico che dall’inquinamento atmosferico generato da tutte quelle auto e quei camion.
Nei motori di tutti questi mezzi avviene, di continuo, una reazione chimica chiamata COMBUSTIONE. Nella combustione degli idrocarburi (benzina e diesel ) si formano:
- Acqua (allo stato di Vapore)
- Anidride Carbonica
- Ossido Di Carbonio (Tossico)
- Ossidi Di Azoto (Tossici)
- Eventuali Idrocarburi Incombusti

Gli idrocarburi sono composti chimici derivati dal petrolio. Da anni ormai, per diminuire l’inquinamento, le auto devono essere dotate di marmitta catalitica. Tale dispositivo deve adempiere a tre funzioni:
- deve completare la combustione di eventuali idrocarburi incombusti.
- deve ossidare l’OSSIDO DI CARBONIO ad ANIDRIDE CARBONICA.
- deve trasformare gli OSSIDI DI AZOTO in OSSIGENO e AZOTO
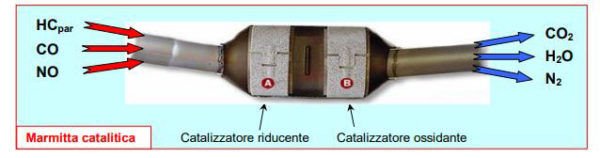
La marmitta catalitica è formata da uno strato di ALLUMINA (composto dell’ALLUMINIO) sul quale viene distribuito una importante quantità di CATALIZZATORE: di solito miscele di RODIO, PLATINO e PALLADIO.
La temperatura ottimale di funzionamento di una marmitta catalitica si aggira intorno ai 250/280°C (infatti dopo l’accensione a freddo non funziona in maniera ottimale).
Vi sono dei metalli, quali il PIOMBO e lo ZINCO presenti negli oli lubrificanti, che possono avvelenare il catalizzatore e quindi diminuire le performances della marmitta catalitica. Per questo motivo è necessario usare lubrificanti adeguati e controllarne il consumo.
Lucrezia, intabarrata nella sua sciarpa, si è avviata verso casa.
LA CHIMICA IN VERSI
di Alberto Cavaliere
CARBONIO
Esso presentasi in vari stati,
amorfi, organici, cristallizzati.
E’ il responsabile primo, essenziale
di tutto il misero regno animale.
Dei corpi organici rappresentante,
è abbondantissimo pur nelle piante.
Non solo: il càlcare, che lo contiene,
di monti origina vaste catene.
Dà con l’idrogeno gl’idrocarburi,
che son moltissimi; né tu misuri
l’enorme numero dei suoi composti,
ché qui ben piccola parte n’accosti,
mentre d’organica tutto un volume
ad esso dedica di scienza un fiume.
Già fin da un secolo più o men remoto,
in tre allotropici stati c’è noto:
il più pregevole, adamantino,
duro, traslucido, è cristallino,
e puro, limpido, forma il diamante,
materia nobile, poco abbondante.
Esso è durissimo, né lo s’incide.
Dà, se in ossigeno brucia, anidride.
E’ grigia e tenera poi la grafite,
onde s’adopera per le matite;
gli archi voltaici l’attaccan, soli,
onde s’adopera per i crogioli.
E c’è, per ultimo, l’amorfo, dato
da un corpo organico che sia scaldato,
purché dell’aria fuor dal contatto:
calor energico lo fa compatto;
e più s’adopera quanto più è duro.
Ma questo, in genere, non è mai puro.
Quando il carbonio venga bruciato
dove l’ossigeno sia limitato,
dà luogo all’ossido, corpo gassoso,
velenosissimo, perciò dannoso.
Riduce gli ossidi, che in sua presenza
spesso d’ossigeno rimangon senza.
Con vapor acqueo, carbon rovente
forma il gas povero rapidamente:
d’ossido e idrogeno è una miscela
(che suol richiedere molta cautela,
perch’è venefica) ed è importante
come economico illuminante,
quando si saturi d’altri vapori;
di più, s’adopera per dei motori
a gas. Dell’ossido infin dirò
ch’è la sua formula questa: CO.
Se combinandosi col cloro viene,
ecco che origine dà al gas fosfene:
in altri termini, l’ossicloruro,
della cui formula son ben sicuro:
s’aggiunga all’ossido un Cl2.
Innominabili le imprese sue:
frutto diabolico d’arti malvage,
fu in guerra un tossico che fece strage.
finché una maschera, che non descrivo,
non venne a renderlo inoffensivo.
E’ indiscutibile, quest’appendice
non ha una sagoma troppo felice,
e molti trovano ch’è meno brutta
la forma classica della bautta;
ma, poi ch’è utile e necessaria,
perché dai tossici depura l’aria,
dati gli spiriti – da quel che opino –
meglio tenersela sul comodino!
C’è poi il biossido: tanto allo stato
libero trovasi che combinato.
E’ un gas venefico senza colore,
il quale formasi quando a -calore
posto è il carbonio d’una sostanza,
dove l’ossigeno sia in abbondanza.
Ha un sapor acido un po’ piccante;
dell’aria libera è, più pesante,
e dove evapora da certi suoli,
cosa che càpita presso Pozzuoli,
là nella celebre Grotta del Cane,
esso negl’infimi strati rimane.
Nell’acqua sciogliesi quando si mette
in tale liquido, però, s’ammette,
quantunque libero non sia esistente,
che formi l’acido corrispondente,
del quale esistono sali svariati,
noti col termine di carbonati.
Cos’è il cianògeno? Corpo composto
che un corpo semplice sembra piuttosto:
infatti è analogo al bromo e al cloro
E’ un gas venefico, vivo, incoloro;
e lo compongono, com’è ben noto
due metalloidi: carbonio e azoto.
Lo si può scindere negli elementi.
Tra i più venefici corpi esistenti,
l’acido prussico, HCN,
dal blù di Prussia prima s’ottenne:
oggi il potassico ferrocianuro c
on il solforico ce lo dà puro.
E’ un corpo liquido, dà molti sali;
è in un gran numero di vegetali.
Trattato a debita distanza va:
la morte provoca senza pietà.

Fausto Bonifacio nasce a Milano nel 1951, si laurea in Chimica Pura nel 1975 e dopo un anno di servizio militare viene assunto, presso un’importante azienda farmaceutica milanese, con la mansione di operatore di laboratorio di ricerca.
Nel 1988 emigra, al contrario, nella città di Frosinone e prende servizio quale direttore della funzione Ricerca e Sviluppo di una nota azienda chimico-farmaceutica operante nel settore della sintesi e produzione di principi attivi .
Nel 1998 viene assunto, con la qualifica di direttore Ricerca e Sviluppo, da una nota azienda chimico-farmaceutica situata nei pressi di Latina e ricopre inoltre lo stesso incarico nella consociata spagnola di tale azienda.
Nel 2004 emigra in toscana presso un’importante azienda chimico-farmaceutica dove ricopre la carica di direttore di stabilimento fino al 2013 quando cessa l’attività lavorativa godendosi poi la meritata pensione.
Attualmente vive e saltuariamente lavora a Latina.


