
Assieme alla busta della spesa che l’amica Sandra ha portato a Lucrezia c’è anche una confezione della profumeria contenente una lacca per unghie, un leva smalto oleoso e dell’anti sfaldante per unghie che Lucrezia aveva ordinato. Vediamo insieme quanta “chimica” c’è in questi prodotti.
LACCA per UNGHIE

Le lacche per unghie formano un film protettivo impermeabile all’acqua sulla superficie ungueale. Oltre al materiale filmogeno classico, il NITRATO DI CELLULOSA, si impiegano oggi anche resine naturali e soprattutto sintetiche, come POLIACRILATI, resine ALCHIDICHE, POLIVINILACETATO, resine FTALICHE, ARILSOLFONAMMIDI etc. Per migliorare le caratteristiche di elasticità, aderenza e lucentezza dei film piuttosto fragili formati da queste resine si aggiungono speciali sostanze plasticizzanti: CANFORA, DIBUTILFTALATO, TRIETILCITRATO, BUTILSTEARATO, TRICRESILFOSFATO etc. Come diluenti o solventi trovano impiego miscele di sostanze organiche di sintesi più o meno volatili: ETANOLO, PROPANOLO, BUTANOLO, ALCOOL AMILICO, DICLOROMETANO, XILENE, TOLUENE etc. Per impartire la colorazione desiderata si usano pigmenti o lacche colorate, nonché coloranti che si sciolgono in alcool o acetone, ciò perché la superficie delle unghie non deve restare colorata quando si asporta la lacca; ovviamente questi pigmenti o lacche sono di origine sintetica quindi chimica.
LEVA SMALTO OLEOSO

Analizziamo l’etichetta – Marca: MANILA, Produttore: Coswell (Rep. Di San Marino), ingredienti:
- – ACETONE
- – ACQUA
- – PEG-7 GLICERIL COCOATO (Polietilen glicole e acidi grassi derivati dall’olio di cocco: olio giallo chiaro con proprietà sgrassanti, lubrificanti ed emollienti)
- – LIMONENE (sgrassante e profumante)
- – CITRALE (profumante e antimicrobico)
- – LINALOLO (profumante: considerato allergizzante, deve essere indicato in etichetta quando supera la percentuale dello 0,01%)
- – CI 14720 (AZORUBINA, colorante E122, di colore rosso con sfumature bluastre, è un colorante alimentare)
ANTI SFALDANTE PER UNGHIE
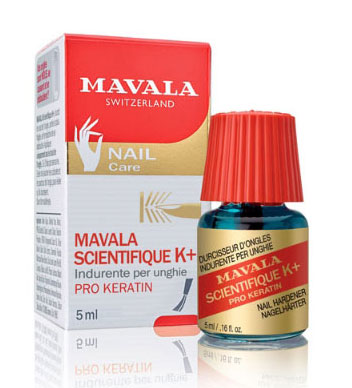
Analizziamo l’etichetta – Marca: MAVALA (Svizzera) – Indicazioni: indurisce il bordo libero delle unghie e ne impedisce lo sfaldamento – ingredienti:
- – ACQUA
- – FORMALDEIDE: è un disinfettante – Facciamo un po’ di chiarezza su questo prodotto: è una delle sostanze più comuni in natura, è un intermedio a vita breve del metabolismo di ogni cellula e si forma in ogni processo di combustione. La FORMALDEIDE, in alte concentrazioni, è tossica per inalazione e per contatto con la pelle, provoca ustioni e può provocare effetti irreversibili. Per questi motivi, in Europa, il suo utilizzo è consentito nei prodotti cosmetici per unghie nella quantità non superiore allo 0,2%.
- – ETANOLO
- – SODIO LAURIL SOLFATO (tensioattivo: facilita la miscibilità tra liquidi diversi)
- – CAMOMILLA
- – AGLIO (bulbo)
- – OLIO di EUCALIPTO
- – TRIETANOLAMMINA (regolatore di acidità)
- – ACIDO BENZOICO (conservante)
Da quanto sopra abbiamo praticamente sfogliato un libro di CHIMICA ORGANICA.
Dopo questa breve lettura Lucrezia, che è laureata in chimica, si sta chiedendo: ma è proprio necessario mettersi sulle unghie tutti questi prodotti chimici?
A voi la riflessione.
LA CHIMICA IN VERSI
di Alberto Cavaliere
AZOTO
Caratteristico ed essenziale del malinconico regno animale,
è diffusissimo; tra i derivati suoi più notevoli sono i nitrati.
Col gas ossigeno, in prima schiera, dà luogo all’aria dell’atmosfera,
e da qui libero lo si converte. E’ un gas insipido, poltrone, inerte.
Ma corpi esistono – nè sono scarsi – con cui benissimo può combinarsi
con catalitici mezzi o, se no, col fluido elettrico che tutto può.
Scariche elettriche nell’aria han dato nitrito ammonico nonchè nitrato.
A caldo uniscesi con dei carburi; dà, con metallici corpi, azoturi.
S’ottiene libero, per via ordinaria, quando l’ossigeno si toglie all’aria:
bruciando fosforo sotto campane di vetro, libero, perciò, rimane.
Ma nell’industria. con il processo dell’aria liquida s’ottien più spesso.
Miscuglio è l’aria, non è composto, come credevasi fosse piuttosto.
A tal proposito, anzi, vi dico che pretendevasi nel tempo antico
che solo fossero quattro elementi del mondo gli unici costituenti:
la terra, l’aria, l’acqua ed il fuoco: se la cavavano con molto poco!
E chi primissimo la luce fe, fu un grande chimico: fu Lavoisier,
che visse in epoca… d’aria funesta e sul patibolo perdè la testa.
L’aria componesi – fece egli noto – del gas ossigeno, del gas azoto;
in una piccola percentuale, ancor n’esistono degli altri, quale
l’elio; ed il cripton, l’argo rammento, che insieme formano l’uno per cento.
Si sa che in genere nei bassi strati, dopo, l’inquinano corpi svariati:
il gas carbonico, che nel passato aria mefitica venne chiamato,
via via sviluppasi se in un ambiente rinchiuso adunasi parecchia gente.
E quando càpita la congiuntura di dover rendere l’aria più pura,
s’applica un metodo ch’è molto buono, sterilizzandola col gas ozono;
ma basta schiudere porte e finestre, anche se il metodo sia più pedestre.
Virtù benefiche l’azoto esprime quando s’adoperi come concime.
Tutti conoscono come i bifolchi spargan sugli aridi sudati solchi
gli avanzi luridi degli animali, mentre, con metodi meno… bestiali,
l’industria chimica, grazie al progresso, può far raggiungere lo scopo stesso.
Tra i sali ammonici, specie il solfato sempre a proposito venne impiegato.
Ma meglio in seguito vi si provvide col sale calcico di cianamide,
di cui la formula vi darò qui: salvo spropositi, questa: N C,
cui segue subito NH2.Han del fantastico le virtù sue,
poiché quel solido senza colore, dell’alma Cerere propiziatore,
con quella formula così scipita,ai campi infondere sa nuova vita.
Rendesse fertile pure il cervello! Sarebbe comodo, sarebbe bello…
Importantissimo è quel composto cui d’ammoniaca nome fu posto.
Prima ottenevasi l’NH3 dal carbon fossile solo, ch’ha in sè
avendo origine da vegetali – l’azoto in piccole percentuali.
Oggi, con metodi più convenienti, s’ottiene libera dagli escrementi,
da peli, tendini, corna e ogni sorta di carne putrida di bestia morta:
prodotti organici che, distillati, d’ammonio formano sali svariati,
d’onde, con semplice procedimento, s’ha d’ammoniaca buon rendimento.
L’industria adopera quelli che ho detto: ma, come metodo di gabinetto,
uno assai facile se ne presenta: cloruro ammonico con calce spenta:
così l’ammonio forma l’idrato, che l’ammoniaca dà, riscaldato;
e sul mercurio, la si raccoglie perché moltissimo l’acqua la scioglie;
poi presto a renderla secca s’arriva:la si fa scorrere su calce viva.
Tanto se libera che in soluzione, ha sempre basica potente azione:
in altri termini, vuol dir ch’è tale che con un acido dà luogo a un sale.
Ed è utilissimo poi far menzione che il sale formasi per addizione.
Dal sale libera ritorna e intatta, se con più energiche basi si tratta.
Gas insoffribile, d’odor spiccato, s’impiega in chimica più come idrato.
Non consigliabile come profumo, ebbe in altr’epoche largo consumo,
poich’era un farmaco fra i più propensi a far riprendere subito i sensi.
Adesso è inutile tanta virtù, perché le femmine non svengon più!
Sono sei gli ossidi che, com’è noto, il gas ossigeno dà con l’azoto
(per via sintetica generalmente), con o senz’acido corrispondente.
S’ottien l’ossidulo, N2O, in modo facile anzichenò,
quando riscaldasi in modo lento nitrato ammonico oltre i duecento.
In dosi piccole è un po’ inebriante, donde il suo titolo d’esilarante;
ma, a parte i chimici, che son dei folli, non sa far ridere nemmeno i polli
(come gli articoli degli umoristi…). E’ un anestetico, noto ai dentisti.
Da quest’ossidulo, corpo gassoso, deriva l’acido iponitroso.
L’ossido (Priéstley lo rese noto) s’ha da un ossigeno con un azoto
mercé fortissimo riscaldamento: oltre i centigradi milleduecento.
E con ossigeno molto abbondante forma il biossido, rosso, ossidante.
Gli altri tre ossidi sono: anidride nitrosa e nitrica e ipoazotide.
Se in aria liquida potente scocchi l’arco voltaico, si forma in fiocchi
verdi azzurrognoli quella nitrosa, nel modo ch’Helbig l’ottenne… in prosa.
Azzurro liquido a men ventuno, dà, scomponendosi, un vapor bruno,
dovuto agli ossidi più su citati, che via si svolgono tra lor mischiati.
Sol noto è l’acido per gl’infiniti sali metallici detti nitriti;
per questo, in genere, in soluzione acquosa, libero lo si suppone.
Segue il tetrossido, che sotto zero soltanto è stabile: scaldato, invero,
vapori elimina d’un rosso scuro, dando il biossido sempre più puro,
finché ai centigradi centocinquanta, tracce il tetrossido neppur più vanta:
è, in altri termini, l’ipoazotide. Eccomi, in ultimo, all’anidride
nitrica: è un solido che si scompone e spesso provoca un’esplosione.
E vengo a porgervi notizie, ahimè!, del potentissimo HNO3,
acido nitrico: composto egregio, l’industria bellica l’ha in sommo pregio.
Liquido instabile, senza colore, a caldo subito manda un vapore
rosso, svolgendosi ipoazotide. Al sole s’altera. Bevuto uccide.
Decomponendosi, diventa giallo. Ossida in genere ogni metallo
e metalloide con forte azione: l’oro ed il platino fanno eccezione.
Da esso formasi quello fumante, acido energico, molto ossidante.
L’acido nitrico vien preparato trattando un acido con un nitrato:
con il solforico s’usò fin qui trattar il celebre nitro Chilì.
Fu la Germania, quando, di botto, non potè giungerle questo prodotto,
per via del rigido blocco del mare, che un nuovo metodo prese ad usare:
quello sintetico, sfruttando, in fondo, l’azoto libero che avvolge il mondo.
In altri termini, l’aria dei vivi servì alla fabbrica degli esplosivi.
Quando al suo simile vuol far del male. l’uomo sa essere sempre geniale…

Continua…
Fausto Bonifacio nasce a Milano nel 1951, si laurea in Chimica Pura nel 1975 e dopo un anno di servizio militare viene assunto, presso un’importante azienda farmaceutica milanese, con la mansione di operatore di laboratorio di ricerca.
Nel 1988 emigra, al contrario, nella città di Frosinone e prende servizio quale direttore della funzione Ricerca e Sviluppo di una nota azienda chimico-farmaceutica operante nel settore della sintesi e produzione di principi attivi .
Nel 1998 viene assunto, con la qualifica di direttore Ricerca e Sviluppo, da una nota azienda chimico-farmaceutica situata nei pressi di Latina e ricopre inoltre lo stesso incarico nella consociata spagnola di tale azienda.
Nel 2004 emigra in toscana presso un’importante azienda chimico-farmaceutica dove ricopre la carica di direttore di stabilimento fino al 2013 quando cessa l’attività lavorativa godendosi poi la meritata pensione.
Attualmente vive e saltuariamente lavora a Latina.


