
Oggi è il turno del FERRO.
Tutti sanno che senza il FERRO si diventa anemici, ma mantenere in perfetta funzione i globuli rossi è solo uno dei compiti che questo metallo svolge nell’organismo, sebbene sia il più importante. Senza FERRO i globuli rossi non sarebbero in grado di prelevare l’ossigeno dall’aria che arriva nei polmoni, né quindi di distribuirlo in tutto il corpo per generare l’energia che ci mantiene in vita, infatti il FERRO è contenuto nell’EMOGLOBINA, una proteina presente nei globuli rossi.
Un altro ruolo importante che svolge il FERRO è quello di essere componente degli enzimi: quelli che partecipano alla sintesi del DNA e quelli che permettono alle cellule di ricavare energia dal glucosio. Il cervello ha bisogno di FERRO per funzionare a dovere e alcune aree ne sono particolarmente ricche, il che può spiegare come mai sia stata osservata una relazione tra le carenze di questo metallo e i ritardi dello sviluppo mentale nei bambini.

Il FERRO è essenziale per quasi tutte le specie viventi, dai microorganismi agli esseri umani. Abbiamo bisogno di un apporto regolare perché ne perdiamo un po’ ogni giorno attraverso le pareti dello stomaco e dell’intestino. Nonostante questo, è raro che una persona in condizioni normali soffra di carenze di FERRO, ad eccezione dei casi di forti perdite di sangue. La tendenza, piuttosto, è ad assumerne troppo con gli integratori alimentari, nella diffusa ma infondata convinzione che aiuti a sentirsi in forma e pieni di energia.

La quantità di FERRO presente in un adulto di peso medio, cioè di 70 chili, è di circa 4,2 grammi. Il fabbisogno medio di FERRO è di 10 milligrammi per un uomo e di 18 milligrammi per una donna, e in genere la quantità contenuta nei cibi è ampiamente in grado di soddisfarlo. Le donne in gravidanza hanno bisogno di un apporto maggiore e dovrebbero mangiare gli alimenti in cui abbonda di più, come il FEGATO, l’uva passa, il pane, le uova, il caviale e la carne di cervo.
L’assorbimento e la perdita di FERRO da parte dell’organismo sono finemente bilanciati. La dieta ne fornisce in media circa 20 milligrammi, una quantità che sembra esagerata, ma è necessaria perché solo 2 dei 20 milligrammi vengono assorbiti ed entrano in circolazione nel sangue. La maggior parte del FERRO che mangiamo passa inalterato attraverso il nostro corpo perché è in una forma inadatta o perché è legato a sostanze del cibo che non riusciamo a digerire. La quantità assorbita è equivalente a quella persa ogni giorno, che ammonta infatti a circa 2 milligrammi.

All’interno del corpo il FERRO è saldamente legato alla TRANSFERRINA, una proteina presente nel siero e in altri liquidi corporei, ed è questa che la trasferisce alle cellule e quindi all’EMOGLOBINA. La TRANSFERRINA si lega strettamente al FERRO e, così facendo agisce da potente antibiotico semplicemente perché evita che il metallo cada nelle mani sbagliate, cioè che sia utilizzato dai batteri invasori che ne hanno bisogno per moltiplicarsi.
Anche il latte materno contiene una forma di TRANSFERRINA, la LATTOTRANSFERRINA, e il bianco dell’uovo contiene la OVOTRANSFERRINA, entrambe agiscono allo stesso modo, legando il FERRO ed esercitando così un’azione antibatterica.
Una curiosità: anche se il FERRO è il quarto elemento per abbondanza nella crosta terrestre (dopo l’ossigeno, il silicio e l’alluminio) ci sono regioni nel pianeta dove è talmente scarso da essere il fattore limitante per la vita.
Ciò accade soprattutto negli strati superficiali di vaste distese oceaniche, che sono prive di vita più di qualunque deserto sulle terre emerse.
Più dell’80% delle sconfinate estensioni superficiali oceaniche sono vuote.
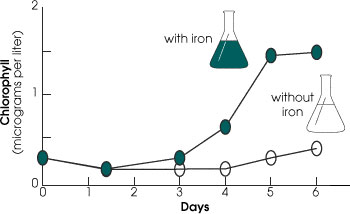
Verso la metà degli anni ’80 John Martin, dei Moss Landing Marine Laboratories in California, ha avanzato la teoria che sia la mancanza di FERRO nelle acque superficiali del mare a impedire la crescita del plancton, e senza il plancton di cui nutrirsi le altre forme di vita marine non hanno di che sostentarsi.

A metà degli anni ’90 l’idea di Martin è stata verificata con successo da una equipe di ricerca statunitense e britannica che ha fertilizzato 60 chilometri quadrati dell’Oceano Pacifico, a ovest delle isole Galapagos, con una soluzione di solfato ferroso. Il risultato è stato impressionante. Nel giro di una settimana questo sterile lembo di oceano si è riempito di vita ed è diventato verde di plancton.
A voi una riflessione
LA CHIMICA IN VERSI
di Alberto Cavaliere
FERRO
Talvolta libero, specie in quei siti
dove si trovano le meteoriti,
è abbondantissimo nei suoi solfuri
e nei suoi ossidi, più o meno impuri.
E da qui libero s’ottien per via
d’una lunghissima metallurgia.
Esso preparasi negli alti forni:
dirò, guardandoli nei lor contorni,
nei lor caratteri più generali,
com’essi trattano i minerali.
Si suddividono in cinque zone:
la prima chiamasi d’essiccazione;
e quivi perdesi – è naturale –
l’acqua igroscopica del minerale.
Nell’altra, in seguito, questo si pone,
zona che chiamasi di riduzione;
di ferro l’ossido quivi è ridotto
con il carbonio; poi va più sotto,
dove combinasi con il carbone,
ciò che facilita la sua fusione
per un fenomeno molto notorio.
Poi nel cilindrico laboratorio
scende, già liquido, dove (spavento!)
segna il termometro milleottocento.
Quivi è il carbonio che a poco a poco
brucia fra gettiti d’aria di fuoco.
E il ferro saturo si cambia in ghisa,
che dalle scorie vien poi divisa,
ma mentre s’opera queste son buone,
in quanto n’evitan l’ossidazione.
La massa liquida va nel crogiuolo,
donde si scarica metallo solo,
perché, con semplice mezzo, da un foro
le scorie colano per conto loro.
La ghisa formasi di ferro impuro,
bianco metallico fragile e duro.
Contien carbonio in vario stato-
silicio, fosforo v’ha combinato,
parti d’arsenico, di manganese,
di zolfo, eccetera, più o meno estese.
L’acciaio, elastico, tenace, duro,
meno fusibile, n’è assai più duro.
Oggi ricavasi quando con cura
la ghisa, in genere, si decarbura.
Se con l’ossigeno trattiam la ghisa,
dai corpi estranei questa è divisa:
s’ha il ferro, duttile, grigio, che a stento
fonde, ai centigradi mille e seicento.
All’aria umida viene alterato
formando ruggine (ossido idrato),
ch’è permeabile e il sottostante
ferro a proteggere non è bastante.
L’acqua, immergendovi ferro rovente,
sviluppa idrogeno rapidamente;
ed il fenomeno si nota pure,
più lento, a piccole temperature.
Son di due serie del ferro i sali.
Ecco i caratteri dei principali.
L’idrato al minimo, quello ferroso,
dapprima è candido gelatinoso,
ma in quello ferrico poi si trasforma,
per cui verdognolo,- bruno è di norma.
Ha reazion debole ed alcalina:
dà sal’ se agli acidi lo si combina.
S’ha per via umida, precipitato,
ma alquanto instabile, il carbonato,
che all’aria s’ossida rapidamente.
Esso negli acidi è effervescente.
Forma, da libero, masse infinite,
note col termine di siderite.
Molto notevole è, il vetriolo
verde, solubile: non è mai solo
nei suoi verdognoli prismi, perché
vuol più molecole d’acqua con sé,
sette molecole più propriamente.
Lo s’ottien libero comunemente
per quanto possano esser seguiti
degli altri metodi – dalle piriti,
perché, ossidandosi, dànno il solfato.
E’ un antisettico molto impiegato.
Poi, lo s’adopera – non è un mistero –
pur nella fabbrica d’inchiostro nero.
L’idrato ferrico, bruno, fioccoso,
quasi insolubile, gelatinoso,
quando arroventasi, si decompone;
d’ossido ferrico s’ha formazione:
è abbondantissimo questo allo stato
di corpo libero cristallizzato,
compatto ed anidro nell’oligisto,
dove a molteplici composti è misto.
Cloruro ferrico s’ha dal ferroso
a cui si prodighi cloro gassoso:
forma verdognoli scuri cristalli,
che quasi splendono come i metalli.
L’acido ferrico è conosciuto
pei sali; libero non s’è ottenuto.
Molto notevoli e numerosi
composti, stabili, non velenosi,
dà col cianogeno questo metallo:
come il potassico prussiato giallo,
cristallizzabile. Ma qui mi curo
solo del ferrico ferrocianuro;
esso precipita azzurro denso;
serba il bellissimo color intenso
per tracce minime del sal, perfino:
si chiama in pratica blù di Berlino.
Altrove pullula, ma, se non erro,
nella Penisola difetta il ferro.
Se per la tecnica del Novecento
è indispensabile quest’elemento,
ripara l’ottima natura al guaio:
abbiamo i muscoli che son d’acciaio!

Fausto Bonifacio nasce a Milano nel 1951, si laurea in Chimica Pura nel 1975 e dopo un anno di servizio militare viene assunto, presso un’importante azienda farmaceutica milanese, con la mansione di operatore di laboratorio di ricerca.
Nel 1988 emigra, al contrario, nella città di Frosinone e prende servizio quale direttore della funzione Ricerca e Sviluppo di una nota azienda chimico-farmaceutica operante nel settore della sintesi e produzione di principi attivi .
Nel 1998 viene assunto, con la qualifica di direttore Ricerca e Sviluppo, da una nota azienda chimico-farmaceutica situata nei pressi di Latina e ricopre inoltre lo stesso incarico nella consociata spagnola di tale azienda.
Nel 2004 emigra in toscana presso un’importante azienda chimico-farmaceutica dove ricopre la carica di direttore di stabilimento fino al 2013 quando cessa l’attività lavorativa godendosi poi la meritata pensione.
Attualmente vive e saltuariamente lavora a Latina.


